L’utilisation des produits de contraste ultrasonographique (PCUS) est décrite comme outil dans l’analyse de la plaque athéromateuse carotidienne afin d’en définir le surrisque éventuel. En effet, le rehaussement intraplaque après injection de produit de contraste est estimé proportionnel au degré de néovascularisation intraplaque. Cette néoangiogenèse est la cause des hémorragies intraplaques, responsables des complications.
L’objectif de cette étude était d’analyser la corrélation entre le rehaussement de la plaque carotidienne asymptomatique et son analyse histologique et immunohistochimique. C’est une étude sur 3 ans (janvier 2014 à décembre 2016), prospective, monocentrique. Elle a concerné 58 patients avec une moyenne d’âge de 73 ans, 33 hommes pour 25 femmes, qui ont été hospitalisés pour bénéficier d’une endartériectomie carotidienne pour une lésion ≥ 70%, asymptomatique.
L’estimation du degré de sténose était réalisée par technique écho-Doppler pour une estimation NASCET (vitesse maximale systolique ≥ 230 cm/sec, rapport carotidien ≥ 4), par réduction du diamètre pour l’estimation ECST et par CT scanner.
L’aspect échographique de la plaque était apprécié selon la classification de Gray-Weale*.
L’acquisition avec injection de produit de contraste était réalisée après injection de 4 ml de produit (hexafluorure de sodium) et rinçage par 5 ml de sérum salé à l’aide d’un cathéter antébrachial. L’index mécanique de la machine était réglé à 0,13 afin de diminuer la destruction des microbulles. Le rehaussement intra luminal était observé entre 15 et 30 secondes après l’injection de produit de contraste. Des clichés ont été réalisés à T 3 secondes avant et T 5 minutes après l’apparition du produit de contraste dans la lumière carotidienne. Un clip était réalisé durant le rehaussement. L’analyse du rehaussement était semi-quantitative, appliquant une classification en 3 grades : grade 0 : absence de rehaussement visible ; grade 1 : rehaussement marginal le long de l’adventice correspondant aux vasa-vasorum physiologiques ; grade 2 : rehaussement diffus et massif. Pour simplifier l’appréciation du rehaussement, les plaques seront classées en 2 niveaux, négatif pour les grades 0 et positif pour les grades 1 et 2 avec un agrément inter-observateur de 0,89 et un K à 0,78 (95% CI 0,67-0,90, p < 0,001).
La cure chirurgicale est classique sous anesthésie générale. La plaque est immédiatement fixée dans du formol tamponné à 10% et décalcifiée avec l’EDTA. Les plaques sont découpées à intervalles de 2 mm et intégrées dans un bloc de paraffine. Elles sont ensuite colorées et analysées par un praticien expérimenté. La microvascularisation est ensuite marquée par immunocoloration au CD34, renforcée par une double coloration CD34/VEGF. La classification semi-quantitative qui comporte 4 grades est simplifiée en 2 niveaux. Le niveau absent/faible (grades 0 et 1, moins de 20% de coloration) et le niveau modéré/fort (grades 2 et 3, 20 à 50% et plus de 50% de coloration). La corrélation intra-observateur est de 0,93 avec K de 0,88 (95% CI 0,83-0,93, p < 0,001).
Les plaques analysées correspondaient à des stades IV, V (plaques non vulnérables) et VI (plaques vulnérables) de la classification AHA. Les plaques de stade VI présentent un ou plusieurs ulcères, des hémorragies ou des thrombi intraplaques ou un grand cœur lipidique nécrotique.
RESULTATS
Cinquante-huit patients asymptomatiques consécutifs répartis en 33 hommes et 25 femmes avec un âge moyen de 72,8 ans ont bénéficié d’une endartériectomie carotidienne.
L’analyse échographique différenciait les plaques anéchogènes (n=27), échogènes (n=26) et non classables (n=5).
L’analyse histologique différenciait les plaques non vulnérables (n=19 : 2 AHA type IV et 17 AHA type V) des plaques vulnérables (n=39 : AHA type VI). Les plaques vulnérables étaient plus fréquentes chez les hommes et les fumeurs actifs.
Le nombre de microvaisseaux intraplaques était significativement plus important dans les plaques AHA type VI que dans les plaques AHA types IV et V (p = 0,04). La coloration CD34/VEGF était modérée/forte dans 77% et absente/faible dans 23% des plaques vulnérables. Pour les plaques non vulnérables, la coloration était modérée/forte dans 37% des cas et absente/rare dans 66% des cas.
La corrélation entre le rehaussement de la plaque et l’intensité du marquage CD34/VEGF était :
1) Non significative pour la population globale de l’étude ;
2) Significative et directe pour les plaques AHA IV et V (p= 0,04) ;
3) Significative et inverse pour les plaques AHA VI (p= 0,01).
DISCUSSION
Les plaques vulnérables ont une densité de microvaisseaux supérieure aux plaques non vulnérables, identifiés par le marquage CD34/VEGF (p= 0,04). Mais ces plaques ne présentent pas de rehaussement plus prononcé avec les PCUS.
L’intensité du marquage CD34/VEGF en analyse immunohistochimique était corrélée avec le rehaussement de la plaque (PCUS), de façon proportionnelle avec les plaques non vulnérables (p= 0,04) et de façon inversement proportionnelle avec les plaques vulnérables (p= 0,01) (Tableau 1).
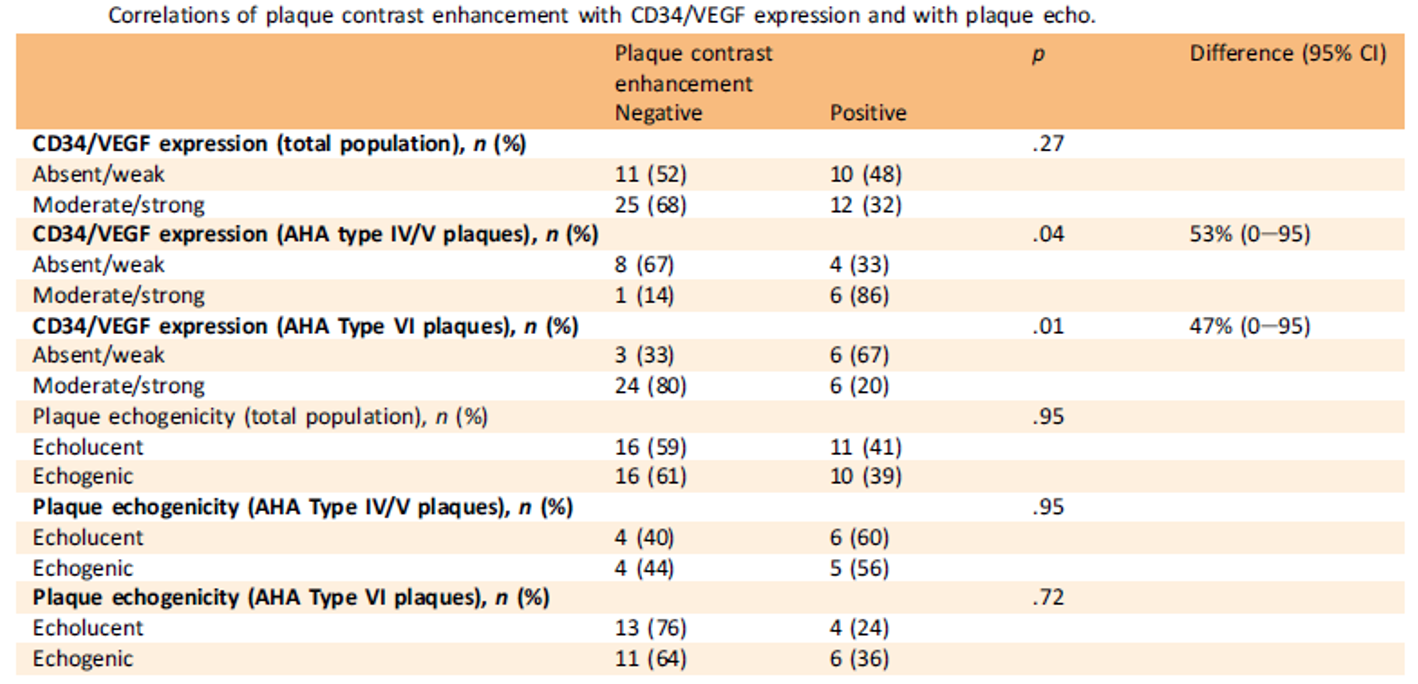
Tableau 1. Corrélations entre rehaussement de la plaque et coloration CD34/VEGF - échogénicité (classification de Gray-Wheale)
Il semble que la pénétration des microbulles au sein des plaques soit différente pour les plaques non vulnérables (via les vasa vasorum) par rapport aux plaques vulnérables (via les fissures de plaques ou transport médié par les macrophages).
Il n’a pas été retrouvé de corrélation entre l’échogénicité de la plaque et le rehaussement de la plaque (Tableau 1), ni de corrélation entre le caractère hypoéchogène de la plaque et la densité de microvaisseaux (Tableau 2).
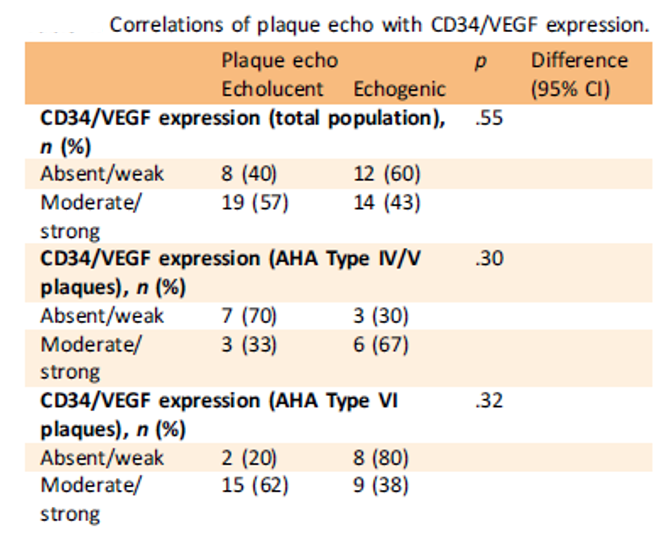
Tableau 2. Corrélations entre échogénicité de la plaque et coloration CD34/VEGF.
Les plaques vulnérables ont une composition morphologique et un fonctionnement complexe que les ultrasons et les produits de contraste ultrasonographique ne peuvent que partiellement analyser. La néo-angiogenèse est un processus biologique important dans lequel le VEGF joue un rôle prépondérant. L’infiltration inflammatoire joue aussi un rôle important, mais de récentes études restent discordantes quant la corrélation entre le rehaussement de la plaque et l’infiltration inflammatoire. De même, une étude récente a trouvé que la néo-angiogenèse et l’inflammation ne sont pas systématiquement associées et qu’il existe une séparation temporelle entre ces deux phénomènes. De ce fait, le rehaussement ne caractérise pas l’inflammation mais seulement le lit de néovaisseaux.
L’étude des plaques en IRM a montré que le lit de néovaisseaux est responsable d’hémorragies intraplaques, de leur accroissement et de leur rupture.
Dans cette étude, une majorité de patients à haut risque étaient traités par antiagrégant plaquettaire et hypolipémiants, ce qui semble stabiliser les plaques (Tableau 3). Il n’y a pas de données qui peuvent prédire le passage d’une plaque asymptomatique à une plaque symptomatique.
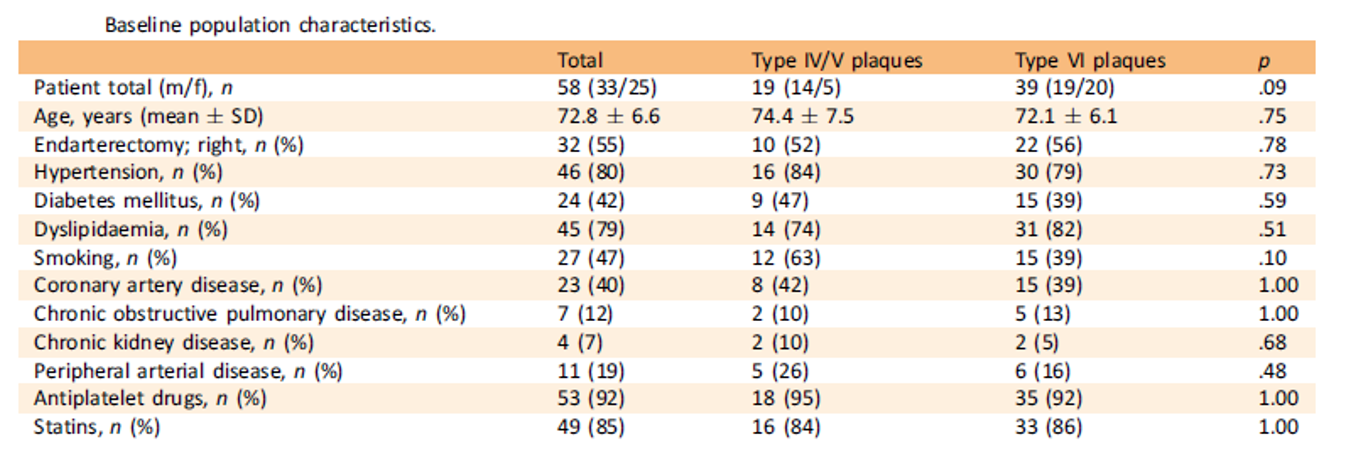
Tableau 3. Caractéristiques de la population.
Les recommandations actuelles (ESVS) ne considèrent pas les PCUS pour définir les plaques asymptomatiques à haut risque. Aucune étude n’a évalué les PCUS pour prédire la survenue d’AVC ipsilatéraux et leur utilité dans l’analyse des plaques asymptomatiques reste incertaine.
De prochaines études devront s’attacher à utiliser des microbulles cibles afin de définir et quantifier les processus moléculaires critiques, utiliser le 3D/4D Doppler pour une évaluation spatiale et temporelle de la plaque.
Les limites de l’étude sont le faible échantillonnage, le recours à un seul relecteur et une estimation semi-quantitative du rehaussement, le protocole choisi avec une forte dose de SonoVue (4 ml) versus les protocoles antérieurs à faible dose (2 ml). On peut considérer aussi le fait de n’utiliser que deux niveaux de classification (positif ou négatif). Enfin la technique peut être de réalisation difficile du fait de la situation de la plaque. En effet, les plaques situées sur le mur postérieur restent plus difficiles à analyser en raison d’artéfacts.
COMMENTAIRES
Ce travail présente une avancée dans la compréhension de l’évolutivité de la plaque athéromateuse carotidienne tout en mettant en avant les limites actuelles des connaissances et de la compréhension des différents stades évolutifs. Il semble, comme le montre les travaux de Vavuranakis (1) et ceux de F. Demeure (2), que l’inflammation intraplaque et la néovascularisation ne sont pas systématiquement associées et peuvent se succéder. De plus, il semblerait que le rehaussement soit plus ou moins marqué en fonction des différents médiateurs impliqués à des stades successifs.
L’analyse du rehaussement de la plaque, s’il reste un outil intéressant à développer, doit s’intégrer dans une batterie de critères, qui pourraient nous permettre de définir les plaques instables ou à risque dont la pertinence doit être démontrée dans des travaux à venir. L’analyse se fait actuellement de manière semi-quantitative avec une bonne reproductibilité inter et intra observateur et ne permet d’analyser qu’une facette de l’évolutivité de la plaque athéromateuse.
* Ndlr : Classification de Gray-Weale : voir LMV 36 : Caractérisation de la plaque carotidienne à risque : revue et pratique quotidienne.P. Giordana, M Dadon.
Références
- Vavuranakis M, Sigala F, Vrachatis DA, Papaioannou TG, Filis K, Kavantzas N, et al. Quantitative analysis of carotid plaque vasa vasorum by CEUS and correlation with histology after endarterectomy. Vasa 2013;42:184e95.
- Demeure F, Bouzin C, Roelants V, Bol A, Verhelst R, Astarci P, et al. Head-to-head comparison of inflammation and neovascularization in human carotid plaques. Circ Cardiovasc Imaging 2017;10:e005846.
